在上一篇文章中,我们初步了解了病理性近视的基础内容,今天带大家来学习“眼底病变的分级方法”,感兴趣的读者请耐心阅读!
基于眼底病变特征的分级方法
对病理性近视病变进行分级有着重要的现实意义。从诊断角度来看,准确的分级能够帮助眼科医生依据不同的病变阶段特征,更精准地判断病情,避免误诊和漏诊情况的发生。比如在疾病早期,一些细微的眼底改变可能容易被忽视,而分级标准可以引导医生关注到这些早期迹象;在干预方面,不同的分级对应着不同的治疗策略和干预手段,合理的分级有助于为患者制定个性化、最适宜的治疗方案,提高治疗效果,延缓疾病进展;对于预后判断而言,分级可以让医生和患者对疾病后续的发展趋势、视力恢复的可能性等有较为清晰的预期,便于采取相应的措施进行视力保护和生活调整等。所以,开展病理性近视病变分级的研究,对改善患者的视力健康以及提升眼科疾病整体诊疗水平都有着至关重要的作用。
病理性近视眼底病变有着多种不同的表现形式,基于这些特征发展出了相应的分级方法,以下为详细介绍:
01 早期分类尝试
在病理性近视眼底病变研究历程中,早期就有学者进行分类方面的探索。例如,Curtin 和 Karlin 曾提出与眼轴长度增加相关的五种眼底改变,包括视神经弧形斑、脉络膜视网膜萎缩、中心色素斑(Fuchs 斑)、漆裂纹以及后巩膜葡萄肿等(见图1),但该分类存在局限性,它没有涵盖所有的病理性近视眼底病变(如脉络膜新生血管等情况),也没有对弥漫性和片状脉络膜视网膜萎缩进行详细区分。
还有 Avila 等人提出了一个黄斑病变的分级量表,整合了诸如视网膜色素紊乱(M1)、后巩膜葡萄肿(M2)、漆裂纹(M3)、局灶性脉络膜萎缩(M4)以及大面积地图样萎缩(M5)等情况,不过此分类存在部分病例无法按照其设定的顺序进展,以及有些病例难以被归类到其中任一类别(比如存在漆裂纹但无葡萄肿的眼睛在该分类中难以准确归类)等问题。
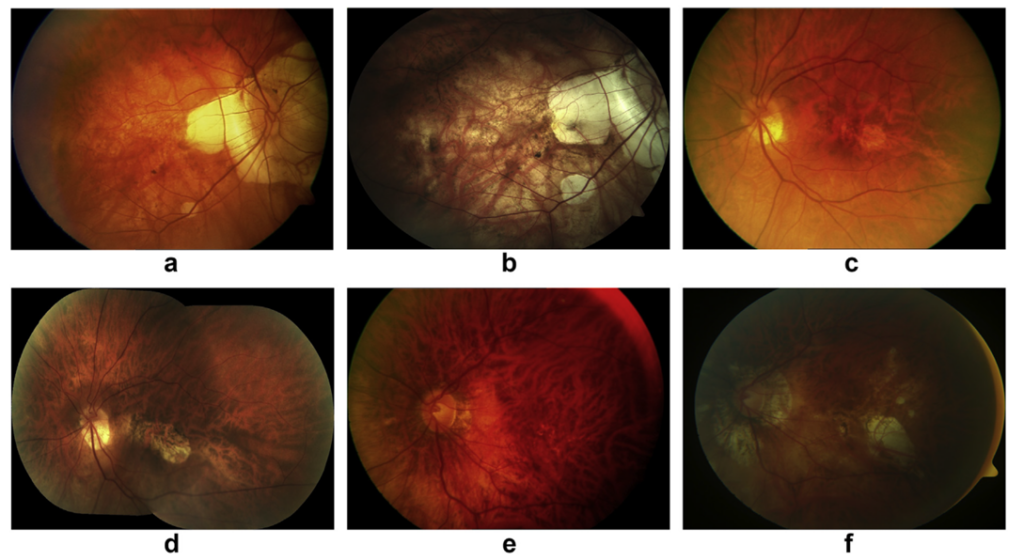
图1:周边视网膜萎缩(a、b)、视网膜劈裂边缘(c、d)及漆裂纹(e、f)等眼底病变特征
02 META-PM分型
目前国际上常用的病理性近视病变分级标准为Ohno-Matsui 等提出的分级系统,即病理性近视-荟萃分析分型(META-PM分型)。
分类类别:
- 0 类:
此阶段无近视性视网膜病变,眼底基本处于相对正常状态,尚未出现因病理性近视导致的特征性改变,视力受影响程度极小。
- 1 类:
仅有豹纹状眼底改变(tessellated fundus),这是由于眼轴增长,视网膜色素上皮层和脉络膜变薄,使得眼底的血管纹理等结构变得更加清晰,呈现出类似豹纹的外观,但此时还未出现明显的视网膜萎缩等病变情况,视力可能开始稍有下降,不过对日常视物影响相对不大。
- 2 类:
存在弥漫性脉络膜视网膜萎缩(diffuse chorioretinal atrophy),意味着视网膜和脉络膜开始出现较为广泛的萎缩性改变,视网膜的功能逐渐受到影响,患者视力下降程度可能会有所加重,视物时可能会感觉清晰度、色彩饱和度等方面出现异常。
- 3 类:
出现斑片状脉络膜视网膜萎缩(patchy chorioretinal atrophy),相较于2类的弥漫性改变,此时萎缩呈现斑片状分布,病变区域更加局限但程度更深,对视网膜功能的破坏进一步加剧,视力下降更为明显,可能还会伴随视物变形等情况出现。
- 4 类:
存在黄斑萎缩(macular atrophy),黄斑是视网膜上视觉最敏锐的部位,当黄斑发生萎缩时,视力会受到极为严重的损害,往往导致中心视力显著下降,甚至可能出现中心暗点等情况,对阅读、驾驶等需要精细视觉的活动造成极大阻碍(见图2)。
- “Plus” 病变补充:
除了上述五个主要类别,还定义了三个作为补充的 “Plus” 病变,用于辅助更全面地评估病变程度:
漆裂纹(lacquer cracks):是视网膜色素上皮层和玻璃膜出现的细小、不规则的线状裂纹,表明视网膜结构的完整性已经受到破坏,增加了后续出现其他病变如脉络膜新生血管等的风险。
近视性脉络膜新生血管(myopic choroidal neovascularization):新生血管的形成是一种病理性的代偿反应,但这些血管往往结构和功能不完善,容易破裂出血,导致黄斑出血、渗出等,严重影响视力,而且一旦出血,吸收过程较为缓慢,容易反复出血,进一步加重病情(见图3)。
Fuchs斑(Fuchs’ spot):表现为黄斑区的黑色或黑褐色的斑点状病变,其实质是视网膜下的出血、渗出等物质逐渐机化形成的,同样会影响黄斑的正常功能,导致视力下降、视物变形等问题。
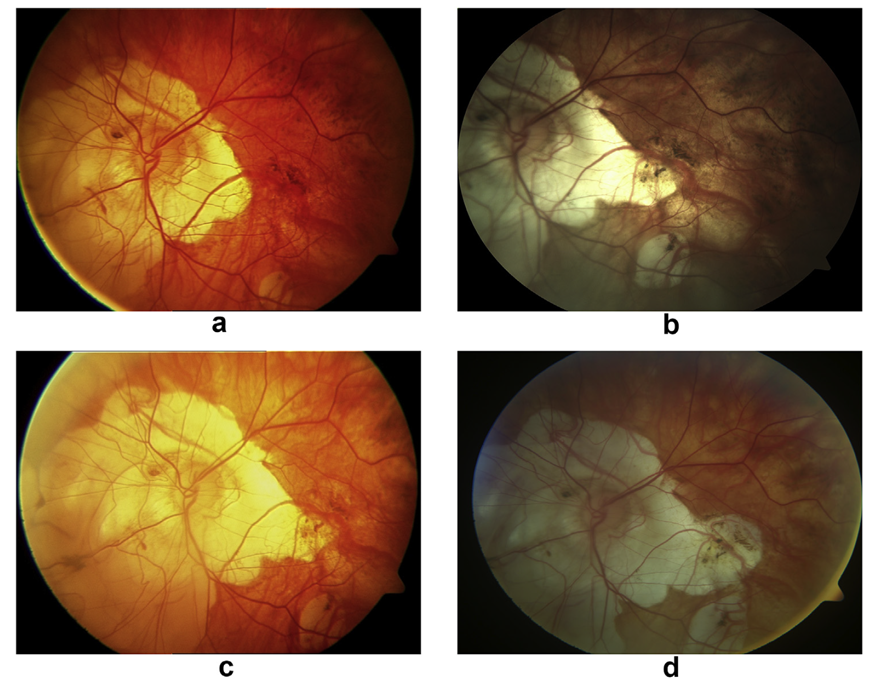
图2:视盘周围脉络膜视网膜萎缩区域逐渐扩大,最终累及黄斑
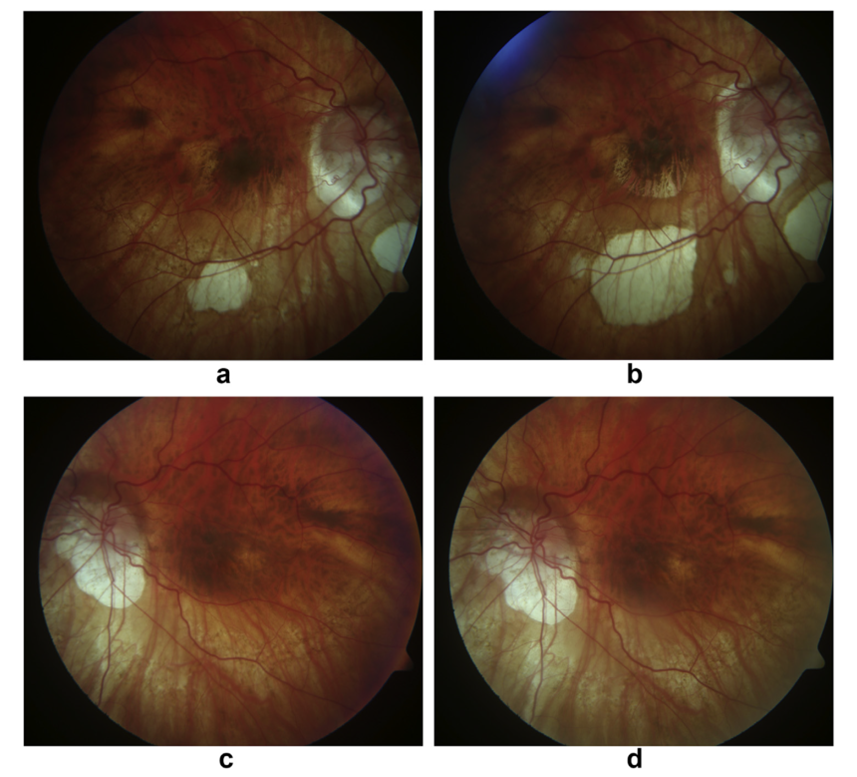
图3:同一近视患者右眼(a,b)与左眼(c,d)的图像。注意左眼(c-d)中围绕中心已愈合的近视性脉络膜新生血管周围萎缩区域的进展情况
03 后巩膜葡萄肿(posterior staphyloma)
后巩膜葡萄肿(posterior staphyloma)是病理性近视最为典型的体征,也是其主要标志。其定义经历了一定的发展和完善,最初被定义为眼球壁的一处向外膨出区域,其曲率半径小于眼球壁周围的曲率。不过,Ohno-Matsui 等人观察到,视乳头周围及鼻侧的巩膜葡萄肿并不总是相较于周围组织产生急剧的曲率变化,而是表现为眼球形状的鼻侧扭曲,进而对定义进行了补充。
虽然多数眼科医生认同后巩膜葡萄肿是近视性黄斑病变的主要原因之一,但它并非唯一原因,即便没有后巩膜葡萄肿,眼轴的过度伸长也可能导致近视性黄斑病变,只是这种情况相对少见。后巩膜葡萄肿的出现往往会决定更严重的病变改变以及更高的近视性黄斑病变患病率,例如近视牵引性黄斑病变、弥漫性脉络膜视网膜萎缩在有巩膜葡萄肿的眼中更为常见,且最佳矫正视力通常更低。
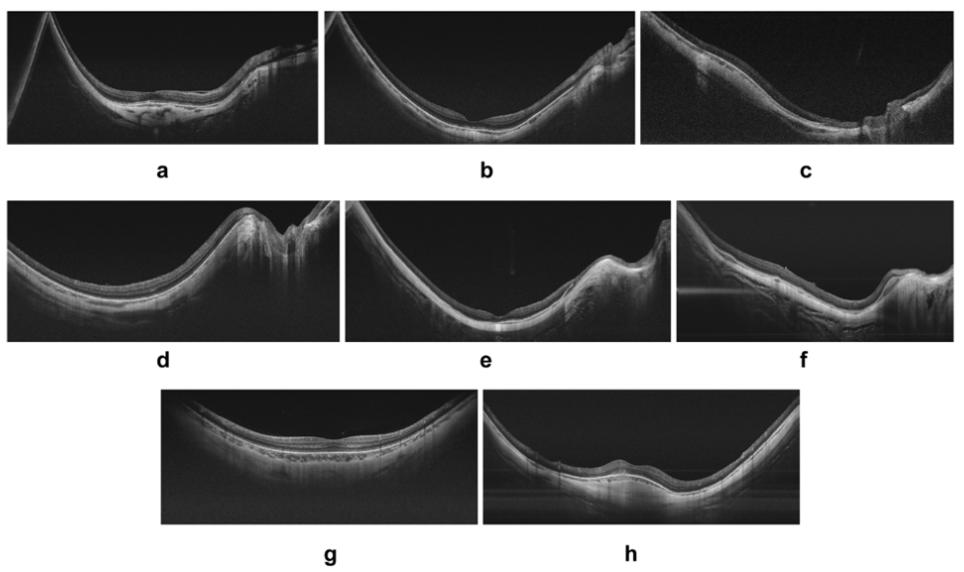
图4:高度近视眼黄斑区的水平扫频源光学相干断层扫描(b-scan)图像。随着眼轴长度的增加,可观察到逐渐加剧的凹陷形态,从轻微凹陷(图a)扩展至更为显着的凹陷(图b)。在某些情况下,视盘位于凹陷的底部(图c)。黄斑轮廓可能呈现出规则形态(图d、e),但在某些个例中,轮廓明显不规则(图f)。大多数情况下,垂直b-scan图像显示为规则的凹面轮廓(图g),不过偶尔也会出现穹顶状的例外情况。黄斑(后区)。
年龄和眼轴长度是高度近视患者出现病理性改变以及巩膜葡萄肿进展的相关危险因素。光学相干断层扫描(OCT)等影像学技术为研究后巩膜葡萄肿提供了有力手段(见图4),不过在高度近视患者中,由于眼球后部特征性的拉长,有时很难获得高质量的图像。
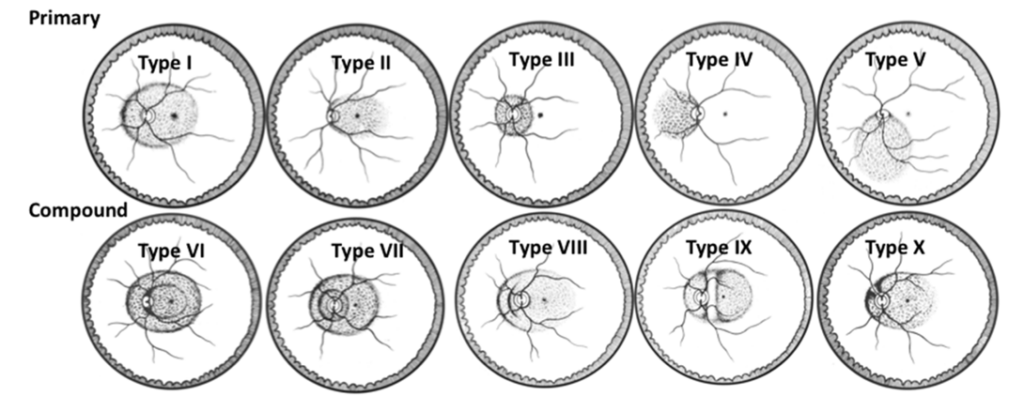
图5:Curtin巩膜葡萄肿分类法。原发性巩膜葡萄肿累及眼的后极部(I型至V型)。VI型和VII型为复合型巩膜葡萄肿,结合了I型与其他类型。VIII型由I型巩膜葡萄肿构成,其壁上有多重阶梯。IX型和X型则是由分隔成多个腔室的I型巩膜葡萄肿形成。源自(Curtin 1977)。
根据其累及范围、与黄斑及视盘的位置关系等又可进一步细分(Curtin 曾将后巩膜葡萄肿基于眼底镜下表现分为 10 种类型,见图5,其中包括 5 种原发性和 5 种复合型。原发性巩膜葡萄肿依据其所涉及的区域进行分类,例如涉及眼球后极(Type I)、黄斑区(Type II)、视乳头周围区域(Type III)、视盘鼻侧区域(Type IV)以及视盘下方区域(Type V)等。复合型巩膜葡萄肿主要是 Type I 巩膜葡萄肿与其他形式的组合,或者涉及原发性 Type I 巩膜葡萄肿壁上的多个台阶等情况。后极部巩膜葡萄肿(Type I)是最为常见的类型,而视乳头周围及下方的巩膜葡萄肿相对罕见。巩膜葡萄肿通常会随年龄增长而扩展和加深,最终趋于对称。不同类型的巩膜葡萄肿与失明的关联性也有所不同,比如在 Curtin 的相关研究中,与巩膜葡萄肿相关的失明平均总体患病率为 34.5%,在最年轻和最年长年龄组中分别为 13% 至 53.5% 不等),它与近视性黄斑病变的发生发展密切相关。该分级系统通过对 100 张病理性近视眼底照片进行评估,观察者内的一致性达到≥85%,加权 kappa 统计量≥0.6,观察者间经过讨论改进后加权 kappa 统计量也能达到≥0.4 的较满意水平,显示出良好的可重复性和可靠性。
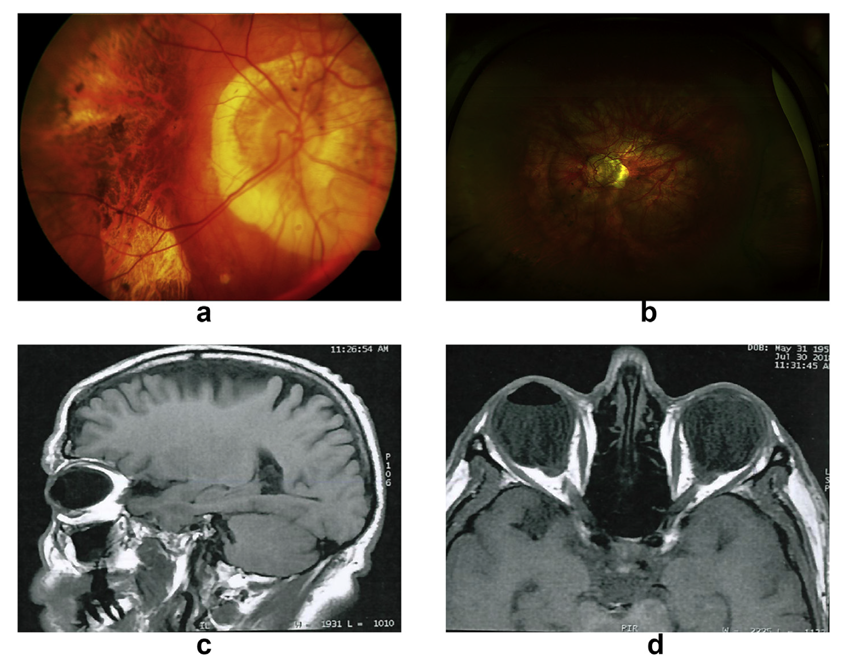
图6:高度近视眼中显著的视网膜色素上皮及脉络膜视网膜萎缩伴垂直型后葡萄肿(图a)。34岁高度近视患者,巩膜扣带术后出现后葡萄肿(图b)。无晶状体高度近视患者左眼视网膜脱离术后磁共振成像,显示前房内气体及后葡萄肿(图c、d)
Ohno-Matsui 在 Curtin 经典分类基础上添加了伴有鼻侧扭曲的鼻侧和视乳头周围巩膜葡萄肿。近年来,随着成像技术的发展,有新的系统根据通过扫频源 OCT(SS-OCT)和磁共振成像(MRI)所获取的数据对巩膜内曲率进行分类,发现高度近视眼中巩膜内表面存在不同的曲率模式,不同模式与近视性脉络膜视网膜病变等情况存在关联。还有诸多学者通过不同的影像学手段,如光谱域 OCT(SD-OCT)、增强深度成像 OCT(EDI-OCT)以及高分辨率 MRI 等,进一步研究后巩膜葡萄肿与其他病变的关系,从不同角度完善对其的认识和分类(参考图6)。
04 ATN分级
除了META-PM分型外,还有如基于ATN分级在病理性近视评定方面的应用。ATN 系统主要依据萎缩性(Atrophic)改变、牵引性(Tractional)改变以及新生血管性(Neovascular)改变这三个维度来对病理性近视眼底病变进行分级(参考表1、图7示例、图8示例)。因为这三种类型的改变基本涵盖了病理性近视眼底病变的主要病理特征,且不同类型的改变之间还可能相互影响、共存于同一眼内。
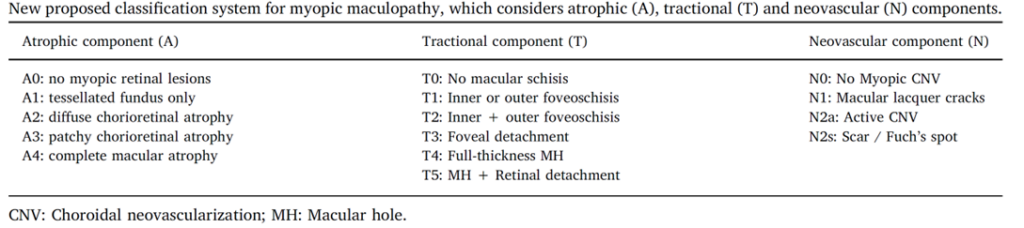
表1:近视性黄斑病变新分类系统,综合考量萎缩性(A)、牵拉性(T)及新生血管性(N)成分
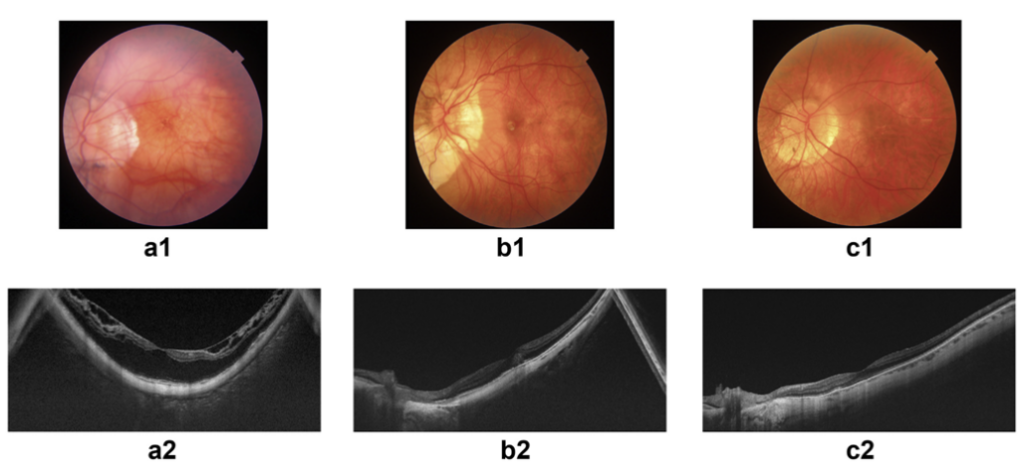
图7:新型近视性黄斑病变ATN分类系统示例: a) 高度近视患者,眼底摄影显示漆裂纹,光学相干断层扫描(OCT)显示内外层视网膜劈裂;ATN分类:A1T2N1。b) 患者表现为弥漫性萎缩,眼底摄影中可见细微的黄斑出血,OCT显示活动性脉络膜新生血管(CNV)病变;分类为A2T0N2a。c) 高度近视患者,OCT检查显示无病变或牵引的铺砖样眼底患者,其ATN分期为A1T0N0。
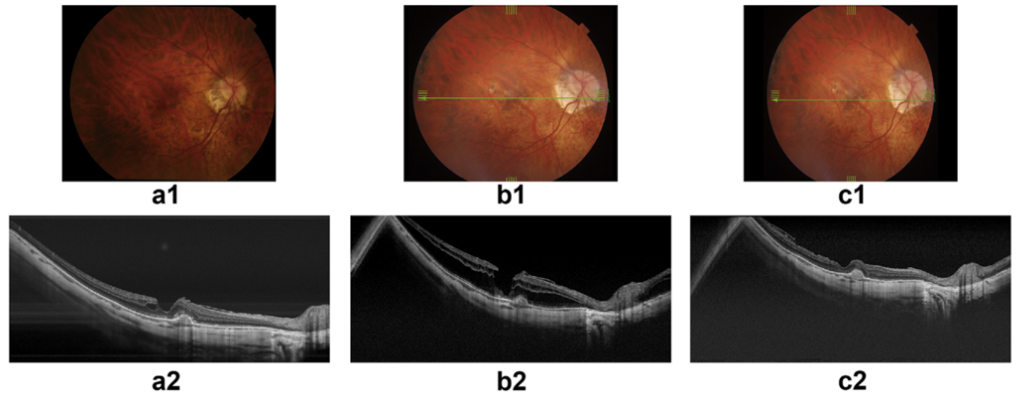
图8:高近视患者随访与进展的ATN分类系统示例:a) 视网膜呈棋盘样外观,存在活动性CNV病变,伴有视网膜下及视网膜内液体积聚,但无黄斑裂孔(A1T0N2a)。 b) 八年后,患者主诉视力下降,表现为斑片状脉络膜视网膜萎缩,出现Fuch斑及黄斑内层裂孔(A3T1N2s)。 c) 患者接受了经平坦部玻璃体切除术及内界膜剥离术。其黄斑裂孔完全愈合,转归为A3T0N2s期
例如在对高度近视患者中近视性黄斑病变致盲和视力损伤情况以及相关危险因素的研究中,就利用ATN分级系统对高度近视患者近视性黄斑病变进行诊断和分级,进而发现年龄较大、眼轴长度较长、近视萎缩性病变分级较高是高度近视患者发生盲或视力损伤的独立危险因素。不同的分级方法有着不同的侧重点,META-PM分型更侧重于从宏观的眼底视网膜、脉络膜等结构的病变特征以及典型病灶角度进行分级,直观地反映出眼底病变的整体进展情况;而ATN分级则聚焦于特定的几个指标,从萎缩情况、眼底的一些特征性表现以及脉络膜相关特征等方面来综合评定病理性近视的程度,更有利于对某几方面病变特征进行细致的量化对比分析,在不同的临床研究和诊疗场景中都发挥着各自的作用。
各级别特点
- A(Atrophic)级——萎缩性改变:
A1:仅存在豹纹状眼底,这是相对早期、较轻微的改变,表现为眼底视网膜色素上皮层和脉络膜毛细血管层变薄,眼底呈现类似豹纹样外观,多见于轻度的高度近视患者,视力可能受影响较小。
A2:出现弥漫性脉络膜视网膜萎缩,此时视网膜、脉络膜等组织的萎缩范围扩大,逐渐影响到黄斑区及周边区域,可伴有视力下降、视网膜血管变直等表现,后巩膜葡萄肿也可能开始出现并逐渐进展。
A3:表现为片状脉络膜视网膜萎缩,萎缩区域呈现片状分布,与弥漫性萎缩相比更加局限但程度可能更重,常伴有色素紊乱,漆裂纹等病变也更容易在此阶段出现,视力损害进一步加重,并且是发生近视性脉络膜新生血管(myopic choroidal neovascularization,mCNV)的重要危险因素之一。
A4:达到黄斑萎缩阶段,是萎缩性改变中最严重的级别,黄斑区的视网膜、脉络膜等结构出现大面积萎缩,中心视力明显下降,可伴有视野缺损等情况,往往预示着较差的视力预后。
- T(Tractional)级——牵引性改变:
T0:无牵引性改变相关表现,视网膜结构相对正常,不存在因玻璃体视网膜牵引等导致的视网膜层间分离等异常情况。
T1:出现轻度的玻璃体黄斑牵引(vitreomacular traction,VMT)或视网膜内界膜(inner limiting membrane,ILM)相关的牵引改变,通过光学相干断层扫描(optical coherence tomography,OCT)等检查可发现视网膜表面有轻微的牵拉迹象,但尚未引起明显的视网膜层间分离或黄斑结构破坏,视力可能仅有轻微波动。
T2:进展到出现近视性黄斑劈裂(myopic foveoschisis),表现为视网膜层间的分离,多由 Müller 细胞连接,根据劈裂的位置可分为内层、外层或内外层同时受累等不同类型,常与后巩膜葡萄肿等同时存在,视力会出现不同程度下降,且随着病情进展有继续恶化风险。
T3:发展为近视性黄斑裂孔(myopic macular hole,MH),黄斑区视网膜全层缺损形成裂孔,可伴有视网膜脱离等严重并发症,视力急剧下降,需要及时干预治疗,否则会导致永久性的视力丧失(见图9)。
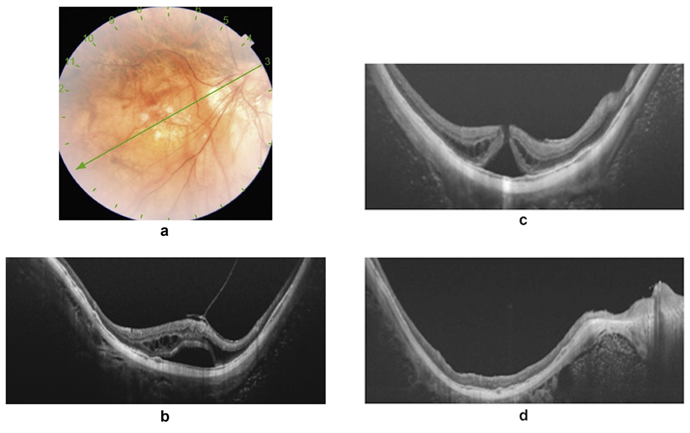
图9:68岁女性患者,表现为黄斑中心凹劈裂伴中心凹脱离,视力为20/100(图a、b)。两周后,病情恶化,出现全层黄斑裂孔(MH),视力降至20/400(图c)。经玻璃体切除术+内界膜剥离+硅油填充术后三个月,光学相干断层扫描显示黄斑裂孔完全愈合,视力改善至20/40(图d)。
- N(Neovascular)级——新生血管性改变:
N0:无近视性脉络膜新生血管形成,眼底没有因新生血管生长导致的出血、渗出等改变,脉络膜血管状态相对稳定。
N1:出现早期的近视性脉络膜新生血管,通过荧光素血管造影(fluorescein angiography,FA)、OCT 等检查可发现有新生血管的存在,此时新生血管可能处于相对不活跃状态,视力开始受到一定影响,如出现视物变形、中心暗点等症状。
N2:近视性脉络膜新生血管处于活动期,有明显的渗出、出血等表现,可导致黄斑区视网膜水肿、增厚,视力下降较为明显,需要积极进行抗血管内皮生长因子(vascular endothelial growth factor,VEGF)等相关治疗来控制病情进展(见图10)。
N3:在新生血管病变后期,即使经过治疗,仍出现了脉络膜视网膜萎缩等并发症,围绕着曾经的新生血管区域出现视网膜色素上皮和脉络膜毛细血管萎缩,视力难以恢复到正常水平,且有继续恶化趋势。
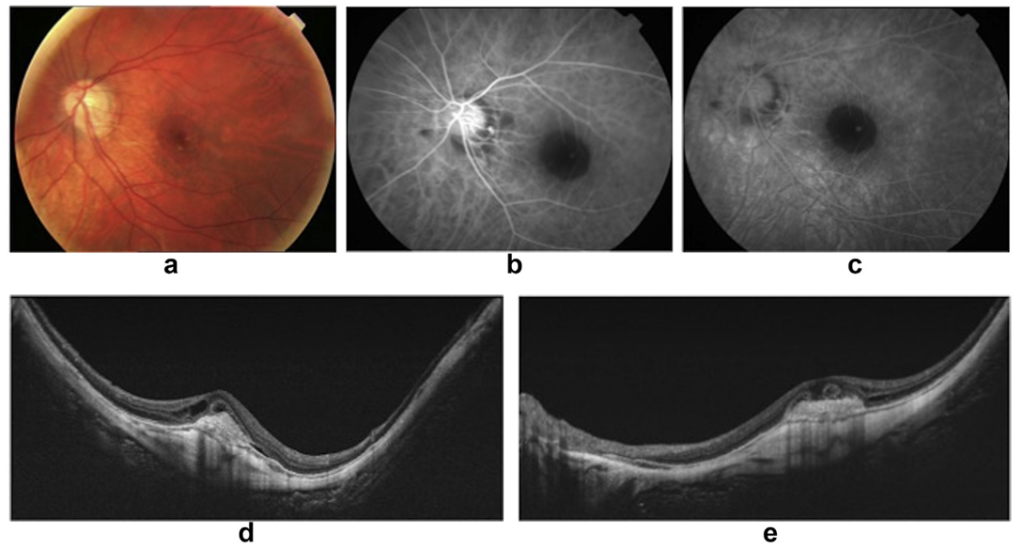
图10:视网膜成像(a)、荧光素血管造影(b,c)及光谱域光学相干断层扫描(d,e)显示了一位高度近视伴有近视性脉络膜新生血管(mCNV)患者的检查结果。这两种技术的联合诊断敏感度可达97%,用于确诊mCNV
本期文章,我们从病理性近视眼底病变的不同表现形式出发,深入学习了这些特征发展出的对应分级方法和各级别特点。下期文章,将围绕实际临床案例展开,探讨病变分级的临床意义。期待您的再次关注!
参考文献:
【1】Ruiz-Medrano J, Montero JA, Flores-Moreno I, et al. Myopicmaculopathy: current status and proposal for a new classification and grading system (ATN). Prog Retin Eye Res 2019;69:80–115
【2】Ye L, Chen Q, Hu G, Xie J, Lv H, Shi Y, Yin Y, Zhu J, Fan Y, He J, Xu X. Distribution and association of visual impairment with myopic maculopathy across age groups among highly myopic eyes – based on the new classification system (ATN). Acta Ophthalmol. 2022 Jun;100(4):e957-e967. doi: 10.1111/aos.15020. Epub 2021 Oct 4. PMID: 34605605; PMCID: PMC9291740
【3】Ohno-Matsui K, Kawasaki R, Jonas JB, Gemmy Cheung CM, Saw SM,Verhoeven VJM, Klaver CCW, Moriyama M, Shinohara K, Kawasaki Y, Yamazaki M, Meuer S,Ishibashi T, Yasuda M, Yamashita H, Sugano A, Wang JJ, Mitchell P, Wong TY, for the METAanalysis for Pathologic Myopia (META-PM) Study Group, International Photographic Classification and Grading System for Myopic Maculopathy, American Journal of Ophthalmology (2015), doi: 10.1016/j.ajo.2015.01.022
【4】Gupta MP, Patel S, Orlin A, Marlow E, Chee RI, Nadelmann J, Chan RVP, DʼAmico DJ, Kiss S. SPECTRAL DOMAIN OPTICAL COHERENCE TOMOGRAPHY FINDINGS IN MACULA-INVOLVING CYTOMEGALOVIRUS RETINITIS. Retina. 2018 May;38(5):1000-1010. doi: 10.1097/IAE.0000000000001644. PMID: 28376042; PMCID: PMC5943072
【5】Ruiz-Medrano J, Flores-Moreno I, Ohno-Matsui K, Cheung CMG, Silva R, Ruiz-Moreno JM. VALIDATION OF THE RECENTLY DEVELOPED ATN CLASSIFICATION AND GRADING SYSTEM FOR MYOPIC MACULOPATHY. Retina. 2020 Nov;40(11):2113-2118. doi: 10.1097/IAE.0000000000002725. PMID: 32073545; PMCID: PMC7575023
作者|李孟琼
编辑|市场部
审核|医学事务部
本文由许根贵副主任医师审核同意发布
文字版权归属许根贵副主任医师和鸥博鹰视所有
仅供专业人士参考
未经授权谢绝转载、翻译及传播





